В последние несколько месяцев уже неоднократно в СМИ пробегали сообщения о тех или иных "коррективах", вносимых новыми данными в привычные представления об эволюции, а также новых теориях, выдвигаемых на основании каких-либо открытий.
Поправки вносились в представления о том, в каких условиях может существовать жизнь и где следует её искать.
Новые внезапные открытия подвергали сомнению общепринятые положения об эволюции человека и его расселении по Земле.
Самой тяжёлой, впрочем, артиллерией в этом отношении оказываются генетики: их заключения становятся порой совершенно революционными.
Однако создание новой формы жизни уже из другой области.
А именно это событие и произошло не так давно.
По правде говоря, создание учёных из института Scripps Research — не совершенно новое существо. Это, если пользоваться технической терминологией, модификация уже существующего организма — причём достаточно известного и крайне широко распространённого.
Речь идёт об "обыкновенной" кишечной палочке Escherichia coli (E. coli), крайне устойчивом ко всяким экстремальным условиям болезнетворном микроорганизме, обитающем в желудках и кишечниках млекопитающих.
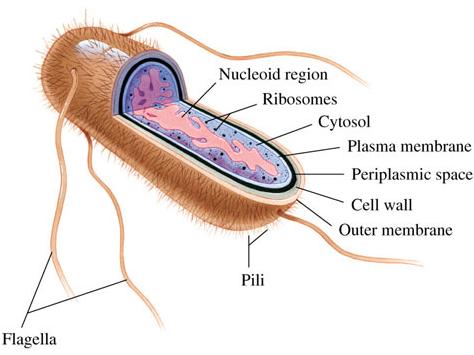 |
Строение кишечной палочки. |
И в то же время, учёные добились того, что их создание с чистой совестью можно назвать новой формой жизни.
Поскольку аминокислотных оснований в генетическом коде "новодела" — не двадцать, а двадцать одно.
Подавляющее большинство естественных белков содержат двадцать аминокислотных остатков (АКО). Хотя барьер этот, надо сказать, далеко не абсолютен.
Некоторые микроорганизмы выработали у себя способность образовывать "нестандартные" аминокислоты, такие как селеноцистеин и пирролизин, например. Впрочем, это всего лишь немного видоизменённые варианты цистеина и лизина.
Но куда больший интерес для учёных представляет возможность вводить в натуральные белки другие нестандартные аминокислоты.
Это было бы крайне полезно для медицинских исследований.
Например, некоторые белки, используемые в терапевтических целях, нуждаются в добавлении различных химических групп, таких как полимеры, соединения с поперечной связью и цитотоксичные молекулы.
Технология, использованная специалистами Scripps может найти применение и в базовых биомедицинских исследованиях. Например, существуют аминокислоты, содержащие флуоресцентные группы, которые можно использовать для того, чтобы "метить" белки, и наблюдать за их поведением и взаимодействием с клетками in vivo.
Кроме того, гидрофобные аминокислоты и кислоты, связывающие тяжёлые металлы, а также кислоты, содержащие спиновые метки, могут быть использованы для зондирования белковых структур, в которые их вводят.
Искусственные аминокислоты, содержащие такие компоненты, как, например, кето-группы, можно использовать для присоединения к ним дополнительных химических структур, например, молекул сахаров, что позволит создавать новые лекарства на белковой основе.
Как явствует из специального пресс-релиза, учёных, как обычно, интересует не столько факт создания, по сути, новой формы жизни, сколько практическое применение их технологии.
В самом внедрении искусственных аминокислот в белки нет ничего нового, однако прежде такие манипуляции можно было проводить только в пробирке. А бактерия с 21 аминокислотой, как уже указано, сама способна вырабатывать модифицированные белки.
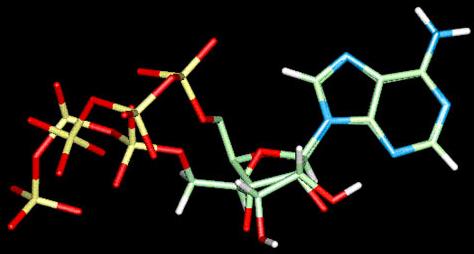 |
Схема, изображающая строение аденина. |
Создать саму бактерию Шульцу и его коллегам удалось благодаря избыточности генетического кода.
В момент экспрессии белка, фермент считывает ДНК-основания гена (аденин, гуанин, цитозин и тимин) и транскрибирует их в РНК (аденин, гуанин, цитозин и урацил).
Информационная РНК (иРНК) затем переводится рибосомой в белок. Рибосоме требуется поддержка молекул транспортной РНК (тРНК), "заряженной" аминокислотой, а для этого требуется поддержка "заряжающего" фермента.
Каждая тРНК распознаёт отдельную трёхосновную комбинацию (кодон) в информационной РНК и "заряжается" только одной аминокислотой, свойственной этому кодону.
В процессе синтеза белков, тРНК, характерная для следующего кодона в иРНК, приходит уже "заряженной" нужной аминокислотой, и рибосома захватывает её и присоединяет к растущей белковой цепочке.
Избыточность генетического кода проистекает из факта существования большего количества кодонов, чем используемых аминокислот. Существует 64 различных способа формирования кодона — или любой трёхзначной комбинации четырёх "букв" (УАГ, АЦГ, УТЦ и так далее). А аминокислот используется (как правило) всего лишь 20.
Однако природа использует некоторые из излишних кодонов: часть из них кодируют одни и те же кислоты, и только три из 64 кодонов не кодируют вообще никаких аминокислот.
Эти кодоны имеют важное значение, поскольку обычно, когда синтезирующая рибосома натыкается на несмысловой кодон, она отделяется от иРНК и синтез прекращается.
Таким образом, несмысловые кодоны называют ещё и стоп-кодонами. Один из них, известный под названием "янтарный стоп-кодон" (урацил-аденин-гуанин — УАГ), сыграл важную роль в исследованиях Шульца.
Шульц знал, что если он введёт в клетки молекулу тРНК, которая распознаёт УАГ (известную как янтарный супрессор), а также фермент, несущий янтарный супрессор с нестандартной аминокислотой, ему удастся найти способ внедрять нестандартную аминокислоту в любой протеин.
Благодаря этой системе, рибосома, считывающая иРНК, внедрит нестандартную кислоту в тот момент, когда ей встретится УАГ. Более того, любой кодон в иРНК, преобразованный в УАГ, будет кодировать новую аминокислоту в том же самом месте, давая Шульцу и его коллегам возможность внедрять эти новые кислоты в белки там, где им нужно.
Используя этот метод, Шульц и его коллеги вводили кислоту О-метил-L-тирозин в белки с точностью переноса более 99% — почти как у естественных аминокислот. Впоследствии то же самое удалось проделать с рядом других кислот, в том числе p-аминофенилаланином, той самой 21 аминокислотой бактерии.
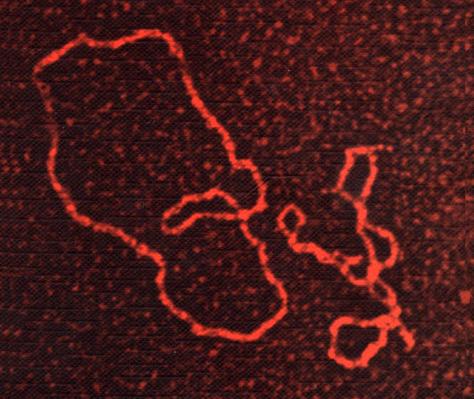 |
Плазмиды, визуализированные с помощью электронного микроскопа. |
Впоследствии, добавив плазмиды — циркулярные фрагменты ДНК, которые вызывают экспрессию метаболических генов, необходимых для производства p-аминофенилаланина, — учёные "научили" бактерию вырабатывать собственные нестандартные аминокислоты и внедрять их в любой протеин, кодируемый иРНК, содержащей кодон УАГ.
Теперь учёным предстоит сравнить уникальную бактерию, содержащей 21 аминокислоту с её "родственницей", обычной кишечной палочкой с 20 аминокислотами, и выяснить, как и насколько различаются их эволюционная адекватность и выживаемость.
Статья получена: Membrana.ru











 Противовирусные препараты: за и против
Противовирусные препараты: за и против Добро пожаловать в Армению. Знакомство с Арменией
Добро пожаловать в Армению. Знакомство с Арменией Крыша из сэндвич панелей для индивидуального строительства
Крыша из сэндвич панелей для индивидуального строительства Возможно ли отменить договор купли-продажи квартиры, если он был уже подписан
Возможно ли отменить договор купли-продажи квартиры, если он был уже подписан Как выбрать блеск для губ
Как выбрать блеск для губ Чего боятся мужчины
Чего боятся мужчины Как побороть страх перед неизвестностью
Как побороть страх перед неизвестностью Газон на участке своими руками
Газон на участке своими руками Как правильно стирать шторы
Как правильно стирать шторы Как просто бросить курить
Как просто бросить курить

 - 2501 -
- 2501 -