Генитальный герпес (ГГ) - широко распространенная болезнь, вызываемая вирусом простого герпеса 1 -го и 2-го типов. В статье рассматриваются вопросы эпидемиологии и патогенеза ГГ, клиническая картина различных форм болезни, основные методы и критерии диагностики, особенности специфической терапии ГГ, такие, как лечение первичного эпизода ГГ, эпизодическая противовирусная терапия, профилактическое применение противовирусных препаратов.
Обсуждаются перспективы лечения и профилактики ГГ, включая не только спецефические противовирусные средства, но и применение вакцин и иммуномодулирующих препаратов.
Введение:
Многие годы генитальный герпес (ГГ) оставался вне зоны внимания врачей практического здравоохранения, что было связано прежде всего с недостаточными возможностями лабораторной диагностики герпесвирусной инфекции, недооценкой роли вируса простого герпеса (ВПГ) в инфекционной патологии человека, а также отсутствием эффективных методов лечения.
В настоящее время ситуация качественно изменилась: появились новые методы диагностики герпесвирусной инфекции на основе молекулярно-биологических принципов, разработаны эффективные методы лечения, во врачебной среде формируется понимание важности проблемы ГГ и его осложнений, касающихся в первую очередь репродуктивного здоровья человека и неонатальной патологии.
Эпидемиология
В начале 70-х годов прошлого века в США и странах Европы был отмечен резкий рост заболеваемости ГГ, которая к 80-м годам увеличилась 10-кратно и составила в Англии и Франции - 80, а в США -178 случаев на 100 тыс. населения [1, 2-4]. Так, в 1999 г. в мире было зарегистрировано 86 млн. больных ГГ (IFMH, 1999). По сравнению с 80-ми годами к концу столетия число зарегистрированных случаев ГГ возросло в США на 13-40%, в странах Европы - на 7-16%. Наиболее высокий рост достиг в Африке - 30-40% [5].
В России официальная статистика ГГ проводится только с 1993 г., и за 5 лет (1994-1999 гг.) заболеваемость увеличилась с 7,4 до 16,3 случая на 100 тыс. населения [6, 7]. Учитывая, что у 20-30% больных ГГ в течение первых 2-3 лет развивается рецидив, общее число таких больных постоянно возрастает, поэтому установить истинное число заболевших не представляется возможным [8-13].
В настоящее время достаточно определенно обозначились причины роста заболеваемости ГГ и основные факторы распространения возбудителя инфекции [14-17]:
- большое число половых партнеров, пренебрежение принципами безопасного секса, раннее начало половой жизни, рост числа гомосексуальных связей;
- бессимптомное течение ГГ, отсутствие контроля за передачей вируса;
- отсутствие учета заболеваемости ГГ и анализа эпидемиологической ситуации, что создает иллюзию отсутствия проблемы герпеса;
- отсутствие интегрированного подхода к тактике ведения больных, рассредоточенных среди специалистов различного профиля;
- отсутствие стандартов диагностики, систем психосоциальной реабилитации, консультирования, профилактики и т. д.
ГГ может вызывается вирусами простого герпеса 2-го (ВПГ-2) и 1-го (ВПГ-1) типов и встречается во всех популяционных группах, причем наиболее высокая заболеваемость зарегистрирована в возрастных группах 20-29 и 35-40 лет [18, 19, 4].
Штаммы, относящиеся к одному и тому же антигенному типу, могут отличаться по иммуногенности, вирулентности, устойчивости к воздействию различных физических и химических факторов, что в конечном итоге определяет особенности клинических проявлений болезни.
Раньше считалось, что штаммы ВПГ-1 чаще удается выделить при поражении кожи лица, верхних конечностей, а штаммы ВПГ-2 - при генитальной локализации очагов, хотя прямой связи между антигенной специфичностью и локализацией очага не обнаруживалось. В настоящее время установлено, что ГГ, вызываемый ВПГ-1, стал обнаруживаться чаще [3, 17].
В Великобритании, например, подсчитано, что в 50% случаев первичный ГГ вызывается ВПГ-1. Генитальная инфекция, вызванная ВПГ-1, рецидивирует гораздо реже, чем при генитальной локализации очага инфекции, вызванной ВПГ-2, составляющей 95% от общего числа больных рецидивирующим генитальным герпесом (РГГ).
Соотношение особенностей вирусов обоих типов при ГГ обнаруживает не только географическую, возрастную, но и социально-экономическую вариабельность: ВПГ-1 чаще выявляется у женщин, страдающих РГГ в возрасте 16-20 лет (55%), у пациентов с низким социально-экономическим статусом ВПГ-1 при РГГ регистрируется в 10% случаев, у пациентов средних социальных слоев - в 50% [2, 5].
Результаты сероэпидемиологических исследований показали также значительную разницу между распространением серопозитивности ВПГ и клиническими проявлениями болезни. Для США и развитых стран Европы наиболее характерна типичная форма РГГ, в то время как для развивающихся стран - атипичное или бессимптомное течение инфекции.
Объясняется это тем, что антитела к ВПГ-2 у белого населения обнаруживаются гораздо реже, чем у лиц негроидной расы, поэтому у последних заболевание протекает чаще атипично [20]. В связи с этим они не обращаются в специализированные учреждения и таким образом являются источниками распространения инфекции.
Согласно данным исследователей, только 20% инфицированных ВПГ имеют диагностированный симптоматический ГГ, 60% - нераспознанный симптоматический герпес (атипичную форму) и 20% - бессимптомный герпес [21, 22]. Установлена также возможность бессимптомного выделения вируса у мужчин и женщин. Кроме риска передачи инфекции половому партнеру, бессимптомное выделение вируса у женщин, очевидно, является важным источником неонатальной инфекции.
С эпидемиологической точки зрения очень важными являются данные об устойчивости ВПГ во внешней среде [18, 19]. При комнатной температуре и нормальной влажности ВПГ сохраняется в течение суток, при температуре 50-52°С инактивируется через 30 мин, а при низких температурах (—70°С) вирус способен сохранять жизнеспособность в течение 5 сут.
На металлических поверхностях (монеты, дверные ручки, водопроводные краны) вирус выживает в течение 2 ч, на влажной стерильной медицинской вате и марле - в течение всего времени их высыхания (до 6 ч).
Патогенез
Основными звеньями патогенеза герпетической инфекции являются:
- инфицирование сенсорных ганглиев вегетативной нервной системы и пожизненная персистенция ВПГ;
- тропизм ВПГ к эпителиальным и нервным клеткам, обусловливающий полиморфизм клинических проявлений герпетической инфекции.
Вирус начинает размножаться в месте инокуляции (входные ворота инфекции): красная кайма губ, слизистые оболочки полости рта, половых органов, конъюнктива, где проявляются типичные пузырьковые высыпания, и проникает в кровяное русло и лимфатическую систему.
На ранних этапах герпетической инфекции вирусные частицы внедряются также в нервные окончания кожи и слизистой оболочки, продвигаются центростремительно по аксоплазме, достигают периферических, затем сегментарных и регионарных чувствительных ганглиев центральной нервной системы, где ВПГ пожизненно сохраняется в латентном состоянии в нервных клетках.
Инфицирование сенсорных ганглиев - один из важных этапов патогенеза герпетической инфекции. При герпесе лица - это чувствительные ганглии тройничного нерва, при герпесе гениталий - ганглии пояснично-крестцового отдела позвоночника, служащие резервуаром вируса для его половой передачи. Распространение ВПГ в центробежном направлении во время рецидива определяет анатомическое постоянство очагов поражения при рецидивах герпеса [9, 19, 23, 24].
В определенных условиях ВПГ размножается в Т- и В-лимфоцитах больного [8, 25, 26].
В последнее время установлено, что ВПГ персистирует также и в эпидермоцитах кожи, эпителии слизистых оболочек и секретах. Вирусемия - обязательный этап как первичной, так и рецидивирующей инфекции. Разнообразие клинических проявлений герпеса объясняется тем, что внедрение вируса не всегда вызывает местную очаговую реакцию [27, 28].
По мнению большинства исследователей, основу различных клинических проявлений инфекции составляют особенности местного и общего иммунитета. Тяжесть течения первичного эпизода и характер иммунного ответа влияют на последующую частоту рецидивов, которые, как правило, возникают у больных с высоким титром антител к ВПГ-2 [21].
В большинстве случаев типичная клиническая картина ГГ позволяет поставить диагноз без применения дополнительных лабораторных методов исследования.
В клинике нередко приходится проводить дифференциальную диагностику между проявлениями ГГ и другими заболеваниями вирусной и невирусной этиологии - мягким шанкром, первичным и вторичным сифилисом, чесоткой, травматическими поражениями гениталий, контактным дерматитом, стрептококковым импетиго, пузырчаткой, пемфигоидом, доброкачественной семейной хронической пузырчаткой Хейли-Хейли, болезнями Дарье, Бехчета, Крона [16]. В таких ситуациях необходима лабораторная диагностика ВПГ.
Диагностика
В практической деятельности наиболее доступными методами диагностики являются [29]:
- молекулярно-биологические - детекция вирусного генома методом полимеразной цепной реакции (ПЦР);
- иммуноморфологические - выявление антигена ВПГ с помощью прямой и непрямой иммунофлюоресценции (ПИФ и НИФ);
- серологические - выявление специфических антител к ВПГ (IgA, IgM, IgG) и антигена методом иммуноферментного анализа (ИФА);
- вирусологические - выделение вируса в культуре ткани из клинического материала и его идентификация;
- цитологические.
Для постановки диагноза ГГ необходимо использовать материал, полученный непосредственно из полового тракта (соскобы эпителия уретры, цервикального канала, слизь, мазки-отпечатки). Непосредственное выявление антигена в клиническом образце указывает на активную репликацию вируса и является методом, конкурирующим по надежности с методом выделения вируса в культуре тканей.
Обнаружение в крови антител к ВПГ-2 не позволяет достоверно судить о наличии у больного ГГ, так как многие используемые коммерческие серологические наборы не способны точно различать антитела к ВПГ-1 и ВПГ-2 из-за высокого (70%) антигенного сродства обоих типов [30, 31, 32].
Окончательные тесты на определение антител к ВПГ-2 должны основываться на детекции ВПГ-2 типоспецифического поверхностного антигена - гликопротеина gGl-gG2. Чувствительность и специфичность серологических тестов на его основе при исследовании крови составляют 95-99 и 100% соответственно [19].
В настоящее время типоспецифическая серология используется преимущественно в научно-исследовательских целях и не применяется в широкой клинико-лабораторной практике.
Чувствительность большинства известных ИФА тест-систем для выявления ВПГ-инфекции варьирует в пределах 48-98,7% и зависит от исследуемого материала. Наличие перекрестных антигенных связей между штаммами, принадлежащими к ВПГ-1 и ВПГ-2 и другими типами герпесвирусов, требует определенной осторожности при интерпретации результатов лабораторных исследований.
В этой группе существует еще один метод - так называемый Western blot analysis: тестирование с помощью твердофазного иммунологического анализа электрофоретически разделенных белков или полипептидов. Метод высокоточен и позволяет дифференцировать антитела к ВПГ-1 и ВПГ-2.
К молекулярно-биологическим методам относится один из самых перспективных современных методов лабораторной диагностики - ПЦР, позволяющий обнаружить единичные копии вирусной ДНК в клетках, биологических жидкостях (кровь, слюна, материал, взятый из уретры или цервикального канала) и биопсированных тканях.
Лечение
Ни один из известных противовирусных химиопрепаратов не способен элиминировать ВПГ из организма. Наиболее реальные перспективы контроля герпесвирусных инфекций связывают с использованием ациклических нуклеозидов для лечения больных.
Эти препараты способны не только купировать острые симптомы болезни, но и предупреждать рецидивы инфекции, уменьшая их частоту и тяжесть клинического течения, предупреждать передачу вируса половым партнерам, что в целом улучшает качество жизни пациентов с РГГ [1,5,33].
Несмотря на то что с начала использования первого представителя препаратов этой группы -ацикловира - прошло около 20 лет, он остается одним из наиболее часто назначаемых противовирусных препаратов и является «золотым» стандартом лечения.
В клинической практике ацикловир заслужил репутацию безопасного препарата, однако его низкие биодоступность (20%) и комплаентность стали причиной разработки препаратов II поколения -валацикловира и фамцикловира [34]. Все они являются ациклическими аналогами гуанозина и проникают преимущественно в инфицированные вирусами клетки.
Валацикловир (1-валиловый эфир ацикловира) под действием гидролазы в печени и кишечнике быстро и почти полностью превращается в ацикловир. При пероральном его применении биодоступность в 3-4 раза больше, чем у ацикловира [11,35].
Фамцикловир (пероральная форма пенцикловира) имеет тот же спектр противовирусного действия, однако биодоступность его выше, чем у ацикловира, и составляет около 77% [12, 36].
Профили безопасности валацикловира и фамцикловира аналогичны ацикловиру. Более редкое дозирование обеспечивает их высокую комплаентность.
Противовирусная терапия должна применяться при всех случаях установления диагноза ГГ. Ее целями являются облегчение выраженности симптомов болезни, предупреждение осложнений и рецидивов [37, 38].
Существуют следующие подходы к противовирусной терапии:
- лечение первичного эпизода ГГ;
- эпизодическая противовирусная терапия (для купирования рецидивов);
- профилактическая (превентивная или супрессивная) терапия (непрерывное лечение на протяжении определенного времени для предупреждения рецидивов).
Половые партнеры пациентов с герпетической инфекцией урогенитального тракта подлежат активному выявлению. Лечение необходимо проводить у них при клинических проявлениях герпеса. Следует рекомендовать воздерживаться от половой жизни или использовать презервативы во время обострений.
Лечение первичного эпизода ГГ проводится с помощью ацикловира, валацикловира или фамцикловира.
При первичном эпизоде ГГ используется ацикловир по 400 мг 3 раза в сутки или по 200 мг внутрь 5 раз в сутки в течение 7-10 дней (в США) или 5 дней (в Европе). При этом сокращается продолжительность выделения вируса и клинических проявлений [5, 39]. Кроме того, ацикловир, возможно, влияет на течение неврологических осложнений, таких, как асептический менингит и задержка мочи.
В тяжелых случаях, сопровождающихся неврологическими осложнениями, ацикловир вводится внутривенно по 5-10 мг/кг 3 раза в сутки [40]. Сравнительное исследование применения высокой пероральной дозы ацикловира (4 г/сут.) и стандартной дозы (1 г/сут.) для лечения первого эпизода генитальной герпетической инфекции не выявило каких-либо клинических преимуществ более высокой дозы [41]..
Международные рекомендации по терапии генитального герпеса
Первичный эпизод генитального герпеса
Европа
Ацикловир 200 мг внутрь 5 раз в сутки в течение 5 дней
Фамцикловир 250 мг внутрь 3 раза в сутки в течение 5 дней
Валацикловир 500 мг внутрь 2 раза в сутки в течение 5 дней
США
Ацикловир 400 мг внутрь 3 раза в сутки в течение 7-10 дней
Ацикловир 200 мг внутрь 5 раз в сутки в течение 7-10 дней
Фамцикловир 250 мг внутрь 3 раза в сутки в течение 7-10 дней
Валацикловир 1 г внутрь 2 раза в сутки в течение 7—10 дней
Лечение можно продолжать более 10 дней, если не зажили элементы
Эпизодическая терапия рецидивирующего генитального герпеса
Европа
Ацикловир 200 мг внутрь 5 раз в сутки в течение 5 дней
Валацикловир 500 мг внутрь 2 раза в сутки в течение 3 дней
Фамцикловир 125 мг внутрь 2 раза в сутки в течение 5 дней
США
Ацикловир 400 мг внутрь 3 раза в сутки в течение 5 дней
Ацикловир 200 мг внутрь 5 раз в сутки в течение 5 дней
Ацикловир 800 мг внутрь 2 раза в сутки в течение 5 дней
Фамцикловир 125 мг внутрь 2 раза в сутки в течение 5 дней
Валацикловир 500 мг внутрь 2 раза в сутки в течение 3-5 дней
Валацикловир 1 г внутрь 1 раз в сутки в течение 5 дней
Супрессивная терапия
Европа
Ацикловир 200 мг внутрь 4 раза в сутки ежедневно
Ацикловир 400 мг внутрь 2 раза в сутки ежедневно
Фамцикловир 250 мг внутрь 2 раза в сутки ежедневно
Валацикловир 500 мг внутрь 1 раз в сутки ежедневно (при частоте рецидивов < 10 в год)
Валацикловир 1 г внутрь 1 раз в сутки ежедневно (при частоте рецидивов > 10 год)
США
Ацикловир 400 мг внутрь 2 раза в сутки ежедневно
Фамцикловир 250 мг внутрь 2 раза в сутки ежедневно
Валацикловир 500 мг внутрь 1 раз в сутки ежедневно (при частоте рецидивов < 10 в год)
Валацикловир 1 г внутрь 1 раз в сутки ежедневно (при частоте рецидивов > 10 в год)
Две исследованные группы пациентов не имели значительных различий в продолжительности симптоматики и выделения вируса, а также во времени до появления первого рецидива. У 8% пациентов, получавших более высокую дозу, возникли нежелательные реакции со стороны желудочно-кишечного тракта, тогда как в группе, получавшей стандартную дозу, они отсутствовали.
В США валацикловир одобрен для лечения первичного эпизода ГГ в дозе 1000 мг 2 раза в сутки в течение 7-10 дней. В многоцентровом исследовании 643 взрослых пациентов с первичным эпизодом ГГ, не имевших каких-либо иных заболеваний, лечились валацикловиром в дозе 1000 мг 2 раза в сутки или ацикловиром в дозе 200 мг 5 раз в сутки. Показано, что оба препарата одинаково эффективно ускоряют разрешение эпизода герпеса и хорошо переносятся.
Ацикловир и валацикловир не имели значительных различий таких показателей, как продолжительность выделения вируса, срок заживления элементов сыпи, продолжительность болей и срок исчезновения всех симптомов.
Нежелательные явления были одинаковыми в обеих группах [13]. В Европе, основываясь на фармакокинетических свойствах, для лечения первого эпизода ГГ валацикловир рекомендуется в дозе 500 мг 2 раза в сутки в течение 5 дней.
Применение 250 мг фамцикловира 3 раза в сутки в течение 5-10 дней также эффективно при первичном эпизоде ГГ, как и применение ацикловира.
В сравнительном исследовании не выявлено значительных различий в сокращении продолжительности выделения вируса при лечении фамцикловиром в дозе 250 мг 3 раза в сутки в течение 5 дней и пероральным приемом 200 мг ацикловира 5 раз в сутки в течение 5 дней [42].
В двух других сравнительных исследованиях при первичном эпизоде ГГ не выявлено значительных различий между применением 125, 250 или 500 мг фамцикловира 3 раза в сутки в течение 10 дней и 200 мг ацикловира 5 раз в сутки в течение 10 дней [43].
Кроме того, применение фамцикловира в дозах 250, 500 или 750 мг 3 раза в сутки в течение 5 дней также эффективно, как и 200 мг ацикловира 5 раз в сутки в течение 5 дней.
Во всех трех исследованиях не выявлено значительных различий в длительности периода, предшествовавшего прекращению выделения вируса, а также сроков полного заживления и исчезновения всех симптомов. Несомненное преимущество фамцикловира перед ацикловиром - меньшая частота его введения, что увеличивает комплаентность.
Эпизодическое лечение рецидивирующего ГГ заключается в применении ацикловира, валацикловира или фамцикловира во время обострений.
Во время рецидивов болезни ацикловир применяется внутрь по 400 мг 3 раза в сутки или 200 мг 5 раз в сутки в течение 5 дней. Хотя данное лечение приводит к уменьшению продолжительности выделения вируса и проявлений симптомов отдельных эпизодов, удлинения интервала между рецидивами не происходит.
В рандомизированном исследовании с плацебо-контролем, в котором сравнивалась эффективность ацикловира и валацикловира, было показано, что оба препарата уменьшают выраженность и продолжительность болевого синдрома [43].
Валацикловир рекомендован для эпизодического лечения РГГ по 500 мг 2 раза в сутки внутрь в течение 3 дней. В плацебоконтролируемом исследовании более 900 пациентов было показано, что валацикловир при начале приема не позднее чем через 24 ч после появления симптомов уменьшал продолжительность рецидивов и ускорял заживление поражений, а также сокращал продолжительность выделения вируса.
Нежелательные явления оказались такими же, как и при приеме плацебо [11]. В сравнительном исследовании использования 500 мг валацикловира 2 раза в сутки и 200 мг ацикловира 5 раз в сутки при эпизодическом лечении РГГ была показана их одинаковая эффективность [44].
Относительно недавно в рандомизированном двойном слепом исследовании 800 пациентов было доказано, что введение 500 мг валацикловира 2 раза в сутки в течение 5 дней не имело значительных отличий от 3-дневной схемы введения с точки зрения срока заживления элементов и продолжительности болевого синдрома. Для ацикловира и фамцикловира подобных исследований не проводилось.
Фамцикловир используется как средство эпизодического лечения РГГ в дозе 125 мг внутрь 2 раза в сутки в течение 5 дней. В двух многоцентровых исследованиях показано, что фамцикловир значительно эффективнее плацебо при обострениях РГГ [45].
Установлено, что введение фамцикловира в дозах 125, 250 или 500 мг 2 раза в день, начатое не позднее чем через 6 ч после появления симптомов, значительно сокращало срок заживления, продолжительность выделения вируса и отека участков поражения.
Кроме того, лечение фамцикловиром значительно уменьшало боль, жжение, болезненность при надавливании. Нежелательные явления фамцикловира не отличались от плацебо.
Профилактическая (превентивная, супрессивная) терапия заключается в применении ацикловира, валацикловира или фамцикловира в длительном непрерывном режиме. Такое лечение показано пациентам с частотой обострений от 6 эпизодов в год.
Ежедневный прием 400 мг ацикловира внутрь 2 раза в сутки предупреждает развитие рецидивов ГГ [46]. При таком использовании частота обострений уменьшается на 80%, а у 25-30% пациентов в течение всего периода приема ацикловира они вообще не возникают [47].
Подавление репликации вируса можно длительно поддерживать без каких-либо существенных нежелательных явлений у больных. При необходимости прием препарата продолжают до 1 года и более. В прошлом предлагалось прерывание лечения каждые 12 мес с целью оценки необходимости продолжения супрессивной терапии. В настоящее время по данному вопросу высказываются противоречивые мнения.
Прерывание лечения требуется не всем пациентам. Лечение должно проводиться с учетом образа жизни и потребности в подавлении, связанной с влиянием физических и психосоциальных факторов. Важным благоприятным эффектом профилактической терапии является снижение психологического давления на пациентов [48].
Валацикловир рекомендуется для супрессивной терапии в дозе 500 мг внутрь 1 раз в сутки (для пациентов, имеющих не более 10 рецидивов в год) или 1 г один раз в сутки (для пациентов, имеющих более 10 рецидивов в год). В сравнительном исследовании приема 500 мг валацикловира один раз в день и приема плацебо было показано, что 69% пациентов, получавших 500 мг валацикловира один раз в сутки, не имели рецидивов в течение 16 нед, тогда как у пациентов, получавших плацебо, они составили только 9,5% [35].
По данным сравнительных исследований, валацикловир также эффективно подавляет ГГ, как и ацикловир [15]. При лечении пациентов, имевших в анамнезе менее 10 рецидивов в год, эффективность валацикловира в дозе 500 мг один раз в сутки достоверно отличалась от таковой при приеме препарата 2 раза в сутки.
Однако при лечении пациентов, имевших в анамнезе не менее 10 рецидивов в год, введение 250 мг валацикловира 2 раза в день, 1000 мг валацикловира один раз в день или 400 мг ацикловира 2 раза в день было более эффективным, чем введение 500 мг валацикловира один раз в день [49].
Фамцикловир также эффективен в подавлении РГГ в дозе 250 мг внутрь 2 раза в день. В двух исследованиях супрессивной терапии РГГ фамцикловиром было показано, что длительное его применение значительно эффективнее, чем плацебо, предотвращало рецидивы, удлиняя интервал времени до следующего эпизода.
В многоцентровом исследовании, включавшем 375 женщин, имевших в анамнезе не менее 6 рецидивов ГГ в год, были подобраны дозы препарата: в течение 4 мес пациентки получали различные дозы фамцикловира (125 мг - один раз в сутки, 125 мг - два раза, 250 мг - один раз, 250 мг - два раза, 500 мг - один раз). Прием 250 мг фамцикловира 2 раза в сутки являлся оптимальным и предотвращал рецидивы у 90% пациенток данной группы, тогда как в группе плацебо обострения отсутствовали лишь у 48% больных [50].
В другом исследовании супрессивной терапии фамцикловиром по 125 мг препарата 3 раза в сутки, 250 мг 2 раза в сутки, 250 мг 3 раза в сутки или плацебо в течение года все 3 режима дозирования фамцикловира значительно отдаляли появление клинически подтверждаемого рецидива. При этом прием препарата 2 раза в сутки было таким же эффективным, как и прием 3 раза в сутки [51].
Все три препарата - ацикловир, валацикловир и фамцикловир - эффективно обеспечивают длительное подавление РГГ. Сравнительные исследования валацикловира и ацикловира показали равноценность этих препаратов.
Бессимптомный герпес
Считается, что бессимптомное выделение ВПГ играет важнейшую роль в передаче инфекции [21]. В многочисленных исследованиях показано, что продолжительная профилактическая терапия противовирусными препаратами значительно уменьшает бессимптомное и субклиническое (в продромальный период) выделение вируса. Так, у 34 женщин с двухлетним анамнезом ГГ прием 400 мг ацикловира 2 раза в сутки в течение 70 дней подавлял субклиническое выделение вируса (0,3% дней от продолжительности исследования по сравнению с 6,9% дней в группе плацебо) [20].
Фамцикловир также уменьшает бессимптомное выделение вируса. Так, при приеме 125 мг фамцикловира 3 раза в сутки, 250 мг фамцикловира 3 раза в сутки и плацебо продолжительность бессимптомного выделения вируса составила 0,52, 0,41 и 3,1% дней соответственно [52]. В другом исследовании было показано, что введение 250 мг фамцикловира 2 раза в сутки значительно эффективнее, чем плацебо, подавляло бессимптомное выделение вируса у мужчин [53].
В исследовании больных СПИДом было показано, что введение 500 мг фамцикловира 2 раза в сутки значительно эффективнее, чем плацебо, уменьшает как выделение вируса, сопровождающееся симптоматикой (0,1 и 4,6% дней соответственно), так и бессимптомное (1,2 и 5,1% дней соответственно) [54].
В исследовании сравнительной эффективности подавления субклинического выделения вируса у мужчин и женщин валацикловиром (500 мг 2 раза в сутки), ацикловиром (400 мг 2 раза в сутки) и плацебо с использованием культивирования вируса оно отмечалось в 0,7, 0,9 и 15,3% дней соответственно. Продолжительность субклинического выделения при использовании ПЦР для определения выделения вируса составила 7,5, 8,4 и 40,0% дней соответственно [22].
Несмотря на явную пользу применения профилактической терапии противовирусными препаратами в отношении бессимптомного выделения вируса, долго оставалась недоказанной ее способность снижать риск передачи ГГ.
В настоящее время завершено одно из исследований дискордантных по ВПГ-2 партнеров с целью определения эффективности профилактической (супрессивной) терапии в предотвращении передачи вируса. В данном плацебоконтролируемом исследовании было показано, что прием валацикловира в дозе 500 мг один раз в сутки статистически достоверно снижает риск трансмиссии ВПГ-2 у гетеросексуальных дискордантных партнеров [55].
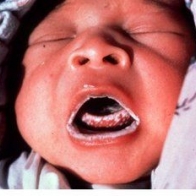
Герпес беременных
Основной причиной герпетической инфекции новорожденных является заражение при прохождении через родовые пути. Возможен и трансплацентарный путь заражения, хотя он наблюдается очень редко [9].
У новорожденных выделяют диссеминированную форму болезни, герпетическое поражение центральной нервной системы и поражение кожи и слизистых оболочек. При своевременном лечении летальность при данных формах инфекции составляет 50, 15 и 0% соответственно. До половины выживших новорожденных могут иметь серьезные неврологические осложнения в отдаленный период [24].
Учитывая большое количество женщин с латентным герпесом, без эпизодов обострения в анамнезе, существует высокий риск бессимптомного выделения вируса в период родов. Идентификация пациенток, относящихся к группе риска, затруднена. Клинические данные, например подробный анамнез генитальных симптомов, также могут оказаться малоинформативными.
Передача вируса новорожденным от матерей, первый эпизод ГГ у которых был отмечен накануне родов, происходит в 20-50% случаев [24]. Частота его передачи от матерей с повторяющимися эпизодами значительно ниже (около 4%) [56]. Однако, учитывая то, что подавляющее большинство активных эпизодов являются рецидивами, существенная доля общего риска связана именно с ними.
Для предупреждения передачи вируса новорожденным было рекомендовано родоразрешение путем кесарева сечения у матерей при развитии эпизода ГГ незадолго до или во время родов. Однако абдоминальное родоразрешение не может полностью исключить возможность заражения новорожденного. У женщин с РГГ для предупреждения обострения во время родов допустимо применение за 4 нед до предполагаемого срока родов супрессивной терапии ацикловиром по 400 мг 2 раза в сутки, но эффективность данного подхода окончательно не доказана.
Так как не существует абсолютных методов профилактики передачи ВПГ во время родов, необходимо тщательное наблюдение за новорожденными, а при признаках заболевания - незамедлительное лечение ацикловиром в дозе 1,5-3 г/м2 внутривенно в 3 введения.
Резистентность и альтернативные методы лечения
Штаммы ВПГ, резистентные к ацикловиру, впервые описаны в 1982 г. [57]. Первоначально они были выявлены у больных с вторичным иммунодефицитом, и с ними связывали клиническое прогрессирование болезни. Результаты исследований показывают, что частота выделения ацикловирорезистентных штаммов ВПГ у иммуннокомпрометированных пациентов составляет примерно 5% [58].
Кроме того, описана резистентность к ацикловиру у штаммов ВПГ, выделенных от пациентов с пересаженным костным мозгом. Хотя сообщения о появлении резистентности у больных с нормальным иммунитетом встречаются редко (0,1-0,6%), какой-либо корреляции между резистентностью in vitro и клиническим прогрессированием не выявлено [59].
В большинстве случаев механизм развития резистентности вируса к ацикловиру заключается в появлении мутантных штаммов ВПГ, неспособных к выработке тимидинкиназы (ТК). В большинстве случаев лечение не влияет на латентную инфекцию.
Таким образом, после окончания химиотерапии происходит реактивация вируса с возвратом чаще всего к исходному типу. Однако возможна и реактивация резистентного вируса. Также могут происходить мутации латентных вирусов, приводящие к резистентности.
Итак, можно предположить, что вирус, чувствительный к препарату, сохраняется в латентном состоянии, а экспрессия ТК является мощным фактором вирулентности вируса.
Помимо штаммов, неспособных к выработке ТК, обнаруживаются (хотя и гораздо реже) мутантные штаммы с измененной функцией ТК или ДНК-полимеразы без изменения вирулентности. Все штаммы, устойчивые к ацикловиру, также резистентны к валацикловиру и большинство - к фамцикловиру.
Представленные данные указывают на необходимость разработки новых подходов к антивирусной терапии герпеса, основанных на альтернативных механизмах действия.
Несмотря на всю серьезность проблемы резистентности, существует мало причин для беспокойства по поводу возможного изменения характера резистентности в целом. С такой же частотой, какая наблюдается в настоящее время, недостаточность ТК обнаруживалась и до введения в практику ацикловира. Кроме того, с момента введения данного препарата частота выделения резистентных штаммов остается стабильной.
В последние 15 лет резко возросло использование противовирусных препаратов, однако каких-либо изменений характера резистентности не произошло. С помощью математических моделей показано, что на развитие значительных изменений частоты резистентности ВПГ потребуется несколько десятилетий [60].
Препараты, используемые для лечения инфекций, вызванных штаммами резистентными к ацикловиру
Фоскарнет
Фоскарнет - это аналог пирофосфата, обладающий широким спектром действия против ДНК- и РНК-вирусов [61].
Фоскарнет не требует фосфорилирования, поэтому он активен в отношении большинства резистентных к ацикловиру штаммов ВПГ, имеющих недостаточность ТК. Однако в некоторых случаях фоскарнет может проявлять токсические свойства. Описаны такие нежелательные явления, как нарушение функции почек, симптомы дисфункции желудочно-кишечного тракта, нарушения обмена веществ (например, магниевого и кальциевого обмена), язвы гениталий и эпилептические припадки. Серьезных нарушений обычно удается избежать путем гидратации и тщательного контроля состояния больного, а также воздержания от одновременного использования пентамидина.
Фоскарнет при ГГ применялся местно, но его эффективность при данном заболевании доказать не удалось. В одном исследовании у 86 пациентов лечение начиналось в первые 24 ч от начала рецидива самими больными путем нанесения крема, содержавшего 0,3% фоскарнета, после чего лечение продолжали путем нанесения крема каждые 2 ч в течение первого дня и далее 6 раз в сутки в течение следующих 4 дней. Обнаружено, что местное применение фоскарнета сокращало период заживления поражений [62]. Однако в другом исследовании (230 больных) эффективность не подтверждена [63].
Фоскарнет эффективен при внутривенном применении при ацикловирорезистентном ГГ в дозе 40 мг/кг 3 раза в сутки [64]. Из-за низкой биодоступности внутрь фоскарнет не применяется. Описаны штаммы ВПГ, резистентные к фоскарнету и ацикловиру [5].
Цидофовир
Цидофовир (НРМРС, GS-504) - это ациклический нуклеозидфосфатный аналог дезоксицитозин-монофосфата, проявляющий активность в отношении широкого спектра вирусов.
Цидофовир фосфорилируется под действием клеточных ферментов с образованием активного дифосфатного метаболита. Поскольку цидофовир является нуклеотидом, он минует первый ВПГ-зависимый этап фосфорилирования, необходимый нуклеозидам, например ацикловиру.
Таким образом, превращение цидофовира в его активный метаболит не зависит от ферментов, кодируемых вирусом, например ТК [65].
Поскольку инфицирование ВПГ не влияет на обмен цидофовира, данный препарат активен как в отношении чувствительных, так и нечувствительных к ацикловиру ВПГ. Это продемонстрировано in vitro на животных моделях и добровольцах [66]. Кроме того, цидофовир с успехом применен для лечения пациентов с пересаженным костным мозгом, пораженных штаммом ВПГ-1, резистентным к ацикловиру и фоскарнету.
Противовирусный эффект цидофовира связан с его взаимодействием с ДНК-полимеразой вируса. Константы ингибирования ДНК вирусов ВПГ-1 и ВПГ-2 в 50-600 раз ниже констант ингибирования ДНК-полимеразы человека. Обнаружено, что цидофовир полностью ингибирует синтез ДНК цитомегаловируса (ЦМВ) при концентрациях не менее чем в 100 раз более низких по сравнению с концентрациями, необходимыми для ингибирования синтеза клеточных ДНК [67].
Это противовирусный препарат широкого спектра действия, проявляющий активность в отношении ВПГ-1, ТК-негативного ВПГ-1, ВПГ-2, вирусов varicella - zoster, Эпштейна - Барра, ЦМВ, вирусов герпеса человека 6-го и 8-го типов, аденовирусов человека, вируса оспы, гепадна- и паповавирусов [67].
В экспериментальных исследованиях однократное местное применение геля, содержавшего 0, 3, 1 и 3% цидофовира, в ближайшие 24 ч после заражения ВПГ-2 в значительной степени предотвращало репликацию вируса и развитие поражений [68].
После удаления цидофовира из среды клеточной культуры внутриклеточные концентрации моно- и дифосфата цидофовира сохраняются в течение 24 и 65 ч соответственно. Такой длительный период полувыведения из клетки позволяет вводить цидофовир внутривенно с интервалом в 1-2 нед при лечении ретинита, вызванного ЦМВ, у больных СПИДом.
Однако цидофовир имеет низкую биологическую доступность при пероральном введении (< 5%), а его период полувыведения из плазмы составляет 2,6 ч [68]. Также при системном применении данный препарат характеризуется высокой токсичностью.
При использовании цидофовира в виде геля для местного лечения ГГ и плацебо 1 раз в сутки в течение 5 дней для лечения 30 больных СПИДом с поражениями, вызванными ВПГ, резистентным к ацикловиру, было обнаружено, что цидофовир обладает значительной противовирусной и клинической эффективностью. Полное заживление отмечено у 27% пациентов, лечившихся 0,3% цидофовиром, у 33% больных при назначении 1% цидофовира и 0% пациентов группы плацебо. Площадь поражений у больных, получавших лечение цидофовиром, уменьшилась на 58%, а в группе плацебо не изменилась [69].
Трифлуридин
Трифлуридин - это аналог пиримидиннуклеозида, который подобно цидофовиру действует независимо от ТК вируса, однако в связи с токсичностью не может быть использован для системного введения. Он эффективен при герпетическом кератите. Имеются сообщения об эффективности трифлюридина при лечении больных СПИДом, пораженных ВПГ-2, резистентным к ацикловиру [70].
Интерферон
Интерферон подавляет пролиферацию ВПГ 1-го и 2-го типов in vitro. Местное применение геля интерферона а-2а 6 раз в сутки является относительно эффективным средством лечения ГГ.
В исследовании, включавшем 188 пациентов с рецидивирующим ГГ, после появления поражений местно применяли высокую дозу интерферона а в метилцеллюлозном геле, содержавшем ноноксинол-9, низкую дозу интерферона альфа в таком же геле с ноноксинолом-9 и плацебо. У пациентов, получавших высокую дозу препарата, сократилась продолжительность выделения вируса, уменьшились выраженность симптоматики и сроки заживления поражений [71].
В другом плацебоконтролируемом исследовании 387 больных была показана эффективность интерферона а-2а при РГГ. Интерферон сокращал продолжительность выделения вируса у всех пациентов, значительно уменьшал боли, зуд и время заживления элементов поражения у мужчин [72].
Новые противовирусные препараты и вакцины
Лобукавир
Лобукавир - это дезоксигуанозиннуклеозидный аналог. Подобно ацикловиру он фосфорилируется вирусной ТК до монофосфата и дополнительно -клеточными киназами до активной трифосфатной формы [73].
Прерывание цепи ДНК возникает вследствие встраивания лобукавиртрифосфата в молекулу ДНК под действием ДНК-полимеразы. Период полувыведения лобукавиртрифосфата из клетки составляет 10 ч. Константы ингибирования ДНК-полимеразы ВПГ-1 и ВПГ-2 сопоставимы с аналогичными константами ацикловира.
Концентрации лобукавира, эффективные в отношении 50% ВПГ-1 и ВПГ-2 in vitro (ЭК50), ниже аналогичных величин для ацикловира. ЭК50 лобукавира в отношении ВПГ-1 с недостаточностью ТК повышается примерно в 30 раз, а ЭК50 ацикловира - более чем в 700 раз. Это позволяет предположить, что фосфорилирование вирусной ТК играет важную, но не единственную роль в противовирусной активности лобукавира.
В исследовании на мышах показано, что пероральное введение лобукавира эффективно в отношении различных поражений, вызванных ВПГ-1 и ВПГ-2. Биодоступность при пероральном приеме составляет 80% [74]. При сравнительном изучении эффективности местного применения крема, содержащего 5% лобукавира или 5% ацикловира, для лечения герпетических поражений у морских свинок установлено, что при начале лечения через 3 ч после заражения 2 раза в сутки в течение 5 дней лобукавир достоверно уменьшал продолжительность и выраженность поражений, чем ацикловир.
В ряде исследований оценено влияние лобукавира на пациентов, серопозитивных в отношении ВИЧ и ЦМВ. В плацебоконтролируемом исследовании (и=40) с использованием одной дозы показано, что абсолютная биодоступность лобукавира при пероральном введении составляет около 40% [75].
Эдоксудин
Эдоксудин - это аналог дезокситимидина, проявляющий значительную активность против вируса герпеса in vitro и in vivo. Он одобрен в качестве средства лечения РГГ в Германии и Канаде. Подобно другим аналогам нуклеозидов эдоксудин нуждается в фосфорилировании вирусной ТК с образованием активной формы, которая ингибирует ДНК-полимеразу.
Эдоксудин лучше абсорбируется из водной кремовой основы, чем ацикловир из полиэтиленгликолевой основы; однако он практически мгновенно разлагается фосфорилазами пиримидиннуклеозида. В многоцентровых исследованиях показано, что местное применение 3% эдоксудинового крема в течение 5 дней при РГГ уменьшало время выделения вируса у мужчин и женщин по сравнению с таковым при назначении плацебо. У мужчин выделение вируса снизилось с 3,4 (группа плацебо) до 2,7 сут (группа эдоксудина), у женщин - с 3,5 до 2 сут соответственно [76].
Формы ацикловира с контролируемым высвобождением
Разработаны формы ацикловира с контролируемым высвобождением, имеющие меньшую кратность применения, что упрощает схему лечения и повышает комплаентность [77]. Результаты исследований свидетельствуют о равноценности данного препарата с пероральной формой ацикловира.
Резиквимод (VML-600)
Резиквимод (VML-600, R-848, S-28463) - это синтетический модификатор иммунного ответа, представитель семейства имидазохинолинов, находящийся в настоящее время в III фазе клинических исследований. Применяется местно в форме геля.
Показано, что резиквимод, аналог имиквимода, вызывает выделение ряда цитокинов in vivo, включая интерферон а, фактор некроза опухоли а и некоторые интерлейкины, за счет модулирования моноцитарно-макрофагальной активности. Обнаружено, что резиквимод уменьшает количество РГГ у экспериментальных морских свинок, причем даже после прекращения введения препарата [78].
Результаты клинического исследования показали, что местное применение резиквимода в течение 24 ч после начала обострения способствует эпителизации поражений при ГГ. У 52 взрослых пациентов с нормальным иммунитетом, имевших не менее 6 рецидивов в год, медиана интервала времени до первого рецидива составила 169 дней в группе резиквимода и 57 дней - в группе плацебо [79].
Вакцины
До настоящего времени не получено ни одной эффективной профилактической вакцины против ВПГ. Природа ВПГ-инфекции, заключающаяся в локальном поражении с последующим латентным периодом без системной вирусемии, приводит к тому, что даже успешная выработка специфических антител не предохраняет от последующего рецидива [80].
В последнее время исследования базируются на использовании 2 из 8 рекомбинантных гликопротеидов D (gD) и В (gB) оболочки ВПГ-2. Между ВПГ-1 и ВПГ-2 существует высокая степень гомологии по этим двум субъединицам (86% ДНК и аминокислотных последовательностей идентичны), причем эти субъединицы характеризуются большим постоянством (99%) у различных штаммов одного и того же типа вируса. Оба протеида обладают высокой иммуногенностью в организме человека, вызывая сильную реакцию выработки антител.
В исследовании ВПГ-2-серонегативных половых партнеров, страдавших ГГ, после введения вакцины на основе гликопротеида, инактивированного ВПГ-2, была обнаружена стимуляция гуморального и клеточного иммунных ответов. Однако вакцина не имела значительного превосходства над плацебо [81].
В другом исследовании пациентов, имевших в анамнезе РГГ, также было обнаружено, что рекомбинантная gD-вакцина повышала уровни ВПГ-2- и gD2-cпeцифичныx антител, но значительного воздействия на частоту рецидивов не выявлено [82].
В последующих исследованиях 137 ВПГ-2-серо-негативных пациентов было обнаружено, что введение вакцины на основе рекомбинантной субъединицы, содержавшей gB2 и gD2 в сочетании с адъювантом MF59, приводило к повышению гуморальной и клеточной реакций на ВПГ-2. Однако в двух крупных рандомизированных исследованиях данной вакцины было показано, что высокие титры специфических нейтрализующих антител не повышают степень защиты от ВПГ-2-инфекции [83]. При анализе данных о 2 тыс. ВПГ-2-серонегативных пациентов выявлено отсутствие значительных различий между вакцинированной группой и группой плацебо в отношении частоты заражения ВПГ-2.
Выработка IgA- и IgG-антител у женщин, серонегативных в отношении ВПГ, и женщин, серопозитивных в отношении ВПГ-1, при внутримышечном введении вакцины на основе рекомбинантных субъединиц gB2 и gD2 вируса 2-го типа оказалась сопоставимой с реакцией на gB2 и gD2 ВПГ-2 при рецидивирующей генитальной инфекции, вызванной этим типом вируса.
Кроме того, применение сочетания рекомбинантных gD2 и gB2 с MF59 (новый адъювант) под контролем плацебо (вводили либо оба гликопротеида + MF59, либо один MF59 на этапах 0, 2, 12 и 14 мес) показало, что в исследуемой группе как у мужчин, так и у женщин значительно сокращался интервал времени до заживления при первом эпизоде ГГ после вакцинации [84]. Помимо этого вакцинация активировала выработку гликопротеидспецифичных и нейтрализующих антител. Однако значительное снижение тяжести эпизода отмечено только у женщин, а ежемесячная частота рецидивов значительно не изменилась ни в одной группе.
Таким образом, данная вакцина не рассматривается в качестве перспективной для лечения ГГ.
В многоцентровом исследовании эффективность убитой вакцины сравнивали с таковой при эпизодическом лечении ацикловиром. В вакцинированной группе по сравнению с группой, получавшей ацикловир, отмечено снижение частоты рецидивов и увеличение количества дней, свободных от заболевания, а также уменьшение продолжительности рецидивов и количества дней активного заболевания в год [85].
Недавно проведенное клиническое исследование рекомбинантной gD2-BaK4HHbi с адъювантом SBAS4 выявило ее значительную эффективность в предотвращении ГГ у женщин, серонегативных в отношении ВПГ-1 и ВПГ-2 [86]. Данная вакцина была неэффективной у мужчин, а также у ВПГ-1-позитивных женщин.
Проводятся исследования возможностей иммунизации ДНК-вакцинами. Данный вид иммунизации впервые продемонстрирован на мышиной модели экспериментального инфицирования вирусом гриппа [83]. В последующих исследованиях такая методика иммунизации была применена в отношении других животных и других вирусных инфекций, включая вирус герпеса.
Так, в исследовании, связанном с вирусом герпеса, для иммунизации морских свинок перед инфицированием ВПГ-2 использовали плазмиду с экспрессией гена gD2 ВПГ-2 [87]. ДНК-вакцина вызывала гуморальный иммунный ответ, аналогичный тому, который наблюдается после заражения ВПГ-2, и защищала животных от первичной генитальной ВПГ-2-инфекции. Репликация ВПГ-2 в месте инфицирования значительно уменьшалась, отмечалось меньшее количество рецидивов со значительно меньшей частотой латентной инфекции в крестцовых спинномозговых узлах.
Ослабленная (на основе вируса с нарушенной репликацией) живая вакцина, содержавшая измененный gH, продемонстрировала иммуногенные свойства в ходе клинических исследований I фазы [88]. Разработку данной вакцины затрудняют несколько факторов:
-во-первых, отсутствует общепризнанный серологический тест, позволяющий различить gH-негативный иммунный ответ и иммунный ответ дикого типа;
-во-вторых, несмотря на нарушение реактивации, у данного вируса нельзя исключить возможность того, что суперинфицирование диким типом может оказаться внешним источником gH, достаточным для реактивации.
Если на данные вопросы будет получен ответ, то откроются очень хорошие перспективы создания живой вакцины против ГГ.
Заключение
Эпидемия ГГ продолжается и имеет всеобщий характер. Несмотря на достигнутые успехи в лечении ГГ, существующие препараты не обеспечивают полной элиминации вирусов из организма. До настоящего времени отсутствуют лекарственные средства системного действия, обладающие длительным периодом полувыведения, способные уменьшить вероятность «прорывов» инфекции в период профилактической (супрессивной) терапии.
Вакцинопрофилактика ГГ находится в стадии научных и экспериментальных разработок.
Остается неизученной степень риска передачи вируса у пациентов после отмены супрессивной терапии, не проводятся регулярные социально-эпидемиологические исследования особенностей распространения ГГ.
Решение этих вопросов позволит выполнить одну из главных задач - установить контроль над распространением этой инфекции и уменьшить ее неблагоприятные медико-социальные последствия.
Литература
1. Бутов Ю.С., Малиновская В.В., Полеско К.В. Герпетическая инфекция: патогенетическое обоснование терапии. Материалы конференции, посвященной 60-летию кафедры кожвенболезней МГСМУ. Москва; 1999. с. 87-8.
2. Benedetti J., Corey L., Ashley R. Recurrence rates in ge-
nital herpes after symptomatic first-episode infection. Ann Intern Med 1994;121:847-54.
3. Fleming D.T., McQuillan G.M., Johnson R.E., et al. Herpes simplex vims type 2 in the United States. 1976 to 1994. N Engl J Med 1997;337:1105-ll.
4. Johnson R.E., Nahmias A.J., Magder L.S., et al. A seroepi-demiologic survey of the prevalence of herpes simplex virus type 2 infection in the United Slates. N Engl J Med 1989;321:7-12.
5. Leung D.T., Sacks S.L. Current recommendation for the treatment of Genital Herpes. Drugs, 2000;60:1329-52.
6. Павлюк А.С. Методы лабораторной диагностики заболеваний, вызванных вирусом простого герпеса. ЗППП 1994;3:3-7.
7. Халдин А.А., Самгин М.А., Малиновская В.В., Суско-ва B.C. Патогенетическое обоснование современного подхода к терапии простого герпеса (ПГ). Актуальные проблемы дерматологии и венерологии: Сб. науч. работ. Москва; 2000. с. 21.
8. Губанова Е.И., Масюкова С.А., Яцуха М.В. Результаты анонимного анкетирования больных рецидивирующим генитальным герпесом. Актуальные проблемы дерматологии и венерологии 2000;2:126.
9. Анохин В.А. Современные принципы клинико-лабо-раторной диагностики герпетических инфекций. Казан мед журн 1999;2:127-9.
10. Климова P.P., Масалова О.В., Атанадзе С.Н., Кущ А.А. Моноклональные антитела в диагностике инфекций, вызываемых вирусом простого герпеса. Журн микро-биол 1999;5:99-103.
11. Spruance S.L., Tyring S.K., DeGregorio В., et al. A large-scale, placebo-controlled, dose-ranging trial of peroral valaciclovir for episodic treatment of recurrent herpes genitalis. Arch Intern Med 1996;156:1729-35.
12. Earnshaw D.L., Bacon Т.Н., Darlison S.J., et al. Mode of antiviral action of penciclovir in MRC-5 cells infected with herpes simplex virus type-1 (HSV-I) HSV-2 and varicella-Zoster virus. Antimicrob Agents Chemother 1992;36:2747-57.
13. Fife K.H., Barabarash R.A., Rudolph Т., et al. Valaciclovir versus acyclovir in the treatment of first-episode genital herpes infection: results of an international, multicenter, double-blind, randomized clinical trial. Sex Transm Dis 1997;24:481-6.
14. Кудашов Н.И., Озерова О.Е., Ворошилова Г.П. О роли вируса герпеса в патогенезе церебральных повреждений и висцеральных нарушений и новорожденных. Акушигин1990;1:24.
15. Хаитов Р.М, Пинегин Б.В. Современные представления о защите организма от инфекции. Иммунология 2000;1:61-4.
16. Климова P.P., Масалова О.В., Семенова Т.Б., Гребен-ча СВ., Абрамова Н.Б., Кущ А.А. Детекция антигена вируса простого герпеса 1-го и 2-го типов при помощи моноклональных антител в клинических образцах. Журн микробиол 1999;6:76-80.
17. Men G.J., Benedetti J., Ashley R., et al. Risk factors for the sexual transmission of genital herpes. Ann Intern Med 1992;116:197-202.
18. Яцуха М.В., Бобкова И.Н., Рыбакова Е.Ю., Новикова А.Г. Динамика заболеваемости вирусными аноге-нитальными инфекциями в 1993-1998 годах. Актуальные проблемы дерматологии и венерологии 2000;2:124.
19. Кунгуров Н.В., Герасимова Н.М., Кузовкова Т.В. Сравнительная характеристика фамцикловира, вала-цикловира и ацикловира в терапии рецидивирующего генитального герпеса. Актуальные проблемы дерматологии и венерологии: Сб. науч. работ. Москва; 2000. с. 35.
20. Wald A., Zeh J., Barnum G., et al. Suppression of sub-clinical shedding of herpes simplex virus type 2 with acyclovir. Ann Intern Med 1996;124:8-15.
21. Mertz G.J., Schmidt D., Jourden J.L., et al. Frequency of acquisition of first-episode genital infection with herpes simplex virus from symptomatic and asymptomatic source contacts. Sex Transm Dis 1985;12:33-9.
22. Wald A., Warren Т., Ни H., et al. Suppression of subclin-ical shedding of herpes simplex virus type 2 in the genital tract with valaciclovir [abstract no. H-82]. The 38th Interscience Conference on Antimicrobial Agents and Chemotherapy: 1998 Sep 24-27; San Diego (CA).
23. Кубанова А.А., Масюкова С.А., Федоров СМ., Резай-кина А.В., Владимирова Е.В. Клинико-лабораторная оценка эффективности фамцикловира при рецидивирующем генитальном герпесе. Материалы научно-практической конференции, посвященной 75-летию ЦКВИ. Москва; 1996. с. 55-6.
24. Масюкова С.А., Владимирова Е.В., Покровская СБ. Противовирусная терапия при генитальном герпесе. РМЖ 2000;15:654-5.
25. Хахалин Л.Н., Соловьева Е.В. Герпесвирусные заболевания человека. Клин фарм тер 1998;1:72-6.
26. Гусейнова З.К., Алиева П.М., Егорова Н.Б. Вакцина ВП-4 в лечении больных герпесом. Актуальные вопросы дерматологии и венерологии: Сб. науч. работ. Москва; 1998. с. 155-7.
27. Тихонова Л.И. О состоянии заболеваемости болезнями, передаваемыми половым путем, и мерах по их предупреждению в России. ЗППП 1997;4:22-6.
28. Шахгильдян В.И. Цитомегаловирусная инфекция. Новый мед журн 1997;2:2-6.
29. Исаков В.А., Архипов Г.С, Аспель Ю.В., Исаков Д.В., Ермоленко Д.К., Коваленко А. Л. и др. Иммунопатоге-нез и лечение генитального герпеса и хламидиоза. Руководство для врачей. СПб; 1997.
30. Аковбян В.А., Борисенко К.К. Современная терапия болезней, передаваемых половым путем. Материалы VII Российского съезда дерматологов и венерологов. Казань; 1995. с. 126.
31. Кицак В.Я. Успехи молекулярной биологии герпесви-русов и перспективы решения прикладных задач диагностики, терапии, эпидемиологии и профилактики герпесвирусных инфекций. Актуальные вопросы эпидемиологии инфекционных болезней 1997;2:294-8.
32. Дубенский В.В. Гематологические и иммунологические показатели при остром и хроническом генитальном герпесе. Актуальные проблемы дерматологии и венерологии 2000;2:44.
33. Владимирова Е.В. Эффективность фамцикловира в лечении рецидивирующего гениального герпеса [диссертация канд]. 1998.
34. Elion G.B., Furman P.A., Fyfe J.A., et al. Selectivity of action of an antiherpetic agent, 9-(2-hydroxy-ethoxymethyl)guanine. Proc Nat Acad Sci USA 1977; 74:5716-20.
35. Patel R., Bodsworth N.J., Woolley I., et al. Valaciclovir for the suppression of recurrent genital HSV infection: a placebo-controlled study of once-daily therapy. Genitourin Med 1997;73:105-9.
36. Vere Hodge R.A. Famciclovir and penciclovir: the mode of action of Famciclovir including its conversion to penciclovir. Antiviral Chemother 1993;4:64-7.
37. Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines 2002. MMWR 2002;51 (No. RR-6).
38. Patel R., Barton S.E., Brown D., Cowan F.M., King-horn G.R., Munday P.E., et al. European guidelines for the management of genital herpes. Int J STD/AIDS 2001;12(Suppl. 3):34-9.
39. Bryson Y.J., Dillon M., Lovett M., et al. Treatment of first episodes of genital herpes simplex virus infection with oral acyclovir: a randomized double-blind controlled trial in normal subjects. N Engl J Med 1983;308:916-21.
40. Corey L., Fife K., Benedetii J.K., et al. Intravenous acyclovir for the treatment of primary genital herpes. Ann Intern Med 1983;98:914-21
41. Wald A., Benedetti J., Davis G., et al. A randomized, double-blind, comparative trial comparing high- and standard-dose oral acyclovir for first-episode genital herpes infections. Antimicrob Agents Chemother 1994;38:174-6.
42. Murphy S.M., Ruck F., Kitchin V.S., et al. Oral famciclovir (FCV) a new antiherpes agent: comparative study with acyclovir in clinic initiated treatment of first episode genital herpes (FGH) [abstract]. The 2nd Congress of the European Academy of Dermatolog and Venereology (EADV) 1991; Athens.
43. Tyring S.K., Douglas J.M., Corey L., et al. A randomized, placebo-controlled comparison of oral valaciclovir and acyclovir in immunocompetent patients with recurrent genital herpes infections. Arch D









 Противовирусные препараты: за и против
Противовирусные препараты: за и против Добро пожаловать в Армению. Знакомство с Арменией
Добро пожаловать в Армению. Знакомство с Арменией Крыша из сэндвич панелей для индивидуального строительства
Крыша из сэндвич панелей для индивидуального строительства Возможно ли отменить договор купли-продажи квартиры, если он был уже подписан
Возможно ли отменить договор купли-продажи квартиры, если он был уже подписан Как выбрать блеск для губ
Как выбрать блеск для губ Чего боятся мужчины
Чего боятся мужчины Как побороть страх перед неизвестностью
Как побороть страх перед неизвестностью Газон на участке своими руками
Газон на участке своими руками Как правильно стирать шторы
Как правильно стирать шторы Как просто бросить курить
Как просто бросить курить

 - 4822 -
- 4822 -